Обзор технологий аддитивного производства для био-имплантов — различия между версиями
Avp (обсуждение | вклад) |
Avp (обсуждение | вклад) (Добавил дополнительные категории) |
||
| Строка 133: | Строка 133: | ||
[[Категория:База знаний]] | [[Категория:База знаний]] | ||
[[Категория:3D-печать]] | [[Категория:3D-печать]] | ||
| + | [[Категория:Переводы]] | ||
| + | [[Категория:Статьи]] | ||
Текущая версия на 11:22, 23 марта 2021
Данная статья является переводом статьи "A Review on Additive Manufacturing for Bio-Implants" под авторством Tajeshkumar R Jadhav и опубликована в ноябре 2019. Статья распространяется на условиях лицензии Creative Commons 4.0 Attribution International.
Авторы перевода: avp, magnapinna
Содержание
I. Введение
Био-материалы -- это материалы, которые совместимы с живыми тканями и могут быть использованы для их замены. На макроскопическом уровне эти компоненты используются для исправления или замены костей, для поддержки процесса лечения. С общемировым повышением среднего возраста популяции, повышается и количество хирургических процедур, что в свою очередь подстёгивает исследователей в улучшении и оптимизации био-материалов. Хотя лечение через установку имплатов имеет высокий показатель успешности, существует фундаментальная проблема, связанная с остеоинтеграцией -- процессом залечивания, протекающем между костью и титановой основой импланта. Процесс остеоинтеграции на поверхности импланта, тем не менее, не интегрирует в себя перидонтальную ткань.
Аддитивное производство входит в свою третью декаду коммерческого и технологического развития. В данный период мы наблюдали множество значительных изменений, которые привели к повышению точности, лучшим механическим свойствам, более широкой области применений технологии, а также уменьшению стоимости машин и деталей, сделанных ими.
По всему миру, примерно 230 миллионов крупных хирургических процедур производятся в рутинном режиме. Большая часть этих процедур включают в себя реконструкцию, восстановление или замену одной или более повреждённой ткани или органа. Разработка тканей в комбинации с аддитивным производством возникла как альтернативная техника для восстановления повреждённых тканей или органов через создание индивидуальных для пациента "заплаток", которые восстанавливают, улучшают или поддерживают функционирование тканей.
Инжиниринг функциональных тканей или органов требует создания скафолдинга, или "строительных лесов", которые выступают в роли шаблона для роста тканей. Аддитивное производство может помочь в создании данных "строительных лесов" , слой за слоем, что может быть особенно применимо к реконструктивным операциям при травмах лица, так позволяет произвести основу со специфическими для анатомии пациента формами. В настоящее время материалы, форсирующие рост кости широко используются в реконструктивных операциях для лечения травм, но инжениринг "строительных лесов" для тканей получит большее распространение в клинической практике по мере прохождения исследований в этой области и клинические испытаний.
Одна из наиболее популярных технологий в области аддитивного производства основы для роста тканей является аддитивное производство на основе экструзии, где большое разнообразие материалов могут быть экструдированы, включая полмимеры, гидро-гели и керамические пасты. Для термопластиков этот процесс известен, как Fused Deposition Modelling (FDM). Во время аддитивного производства с экструзией материала, нити экструдируются из сопла и размещаются относительно друг друга в соответствии с шаблоном, заданным пользователем.
II. Технология производства био-имплантов
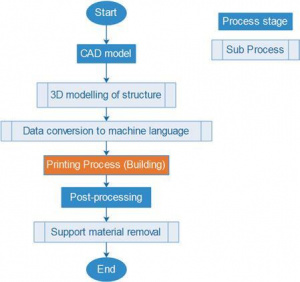
Аддитивное производство (AM) также известно, как быстрое прототипирование (RP) или 3D-печать включает в себя различные методы автоматизированного производства. Процесс аддитивного производства состоит из моделирования дизайна и собственно производства. 3D-модели могут быть разработаны в САПР, получены через CT сканирование или же MRI. После этого модель конвертируется в формат STL (стереолитография) или же новый AFM формат, затем нарезается на последовательность 2D-слоёв, что в итоге даёт файл, содержащий инструкции для принтера по пути, которому он должен следовать. Процесс обхода пути обычно идёт снизу вверх. В зависимости от выбранной AM-технологии, изготовленные детали могут требовать или не требовать пост-обработку для получения законченного продукта. Другими преимуществами являются кастомизация, низкая стоимость, меньшее количество инструментов и меньше технических знаний для управления машинами. Тем не менее, при всех преимуществах AM имеет некоторые недостатки, такие, как необходимость в пред- и пост-обработки, ограниченный набор материалов, доступных для печати и высокая стоимость оборудования.
A. Биопечать
Одним из наиболее сложных применений аддитивного производства является изготовления скаффолдинга. Для специфических требований восстановления перидонта, многофазовые скаффолды имеют значительные преимущества, так как они способствуют компартментализированному заживлению тканей.[original-sources 1][original-sources 2] В то время, как данная стратегия является многообещающей, подход требует оптимизации и обширного тестирования на животных и, в конце-концов, клинических исследованиях на человеке. Учитывая сильные стороны адиттивного (био)производства, ожидаются интересные разработки в области восстановительной периодонтологии. Одна из таких разработок включает в себя технологии био-производства, такие, как биопечать, которая подразумевает печать всех компонентов, формирующих определённую ткань, вместе с живыми клетками, интегрированными в матричеый материал для получения структур, аналогичных естественным.[original-sources 3] Хотя применение био-печати для изготовления оральных тканей находится всё ещё на ранних стадиях, данная стратегия показала интересные результаты в различных практических исследованиях и выглядит многообещающей, развиваясь за пределы шаблонов и моделей.[original-sources 4] Тем не менее, для успешного перевода технологии в область клинического применения, необходимо разработать дорожную карту, которая включает в себя исследования, требуемые для одобрения FDA и пометку "CE" на ранних стадиях процесса. В дополнение к этим общим сертификатам, существует срочная потребность в методических рекомендациях и протоколах для стандартизации в области аддитивного био-производства. Соответственно, эти производственные и инжигиринговые стандарты должны быть совмещены с нюансами биологии. И, самое главное, нужно принять во внимание тот факт, что биопечать, с точки зрения практического подхода, направлено на персонализацию под конкретного пациента. Таким образом одной из крупнейших проблем в этой области является стандартизация при сохранении возможности персонализации.
B. Современные технологии производства
]В текущем цифровом веке цифрового производства такие технологии, как сканеры для компьютерной томографии (КТ сканирование костей) и для магнитно-резонансной томографии (МРТ для мягких тканей), используются для изучения и создания трёхмерных компьютерных моделей любой повреждённой кости или мягкой ткани в человеческом теле.[original-sources 5][original-sources 6][original-sources 7] Эти модели могут быть импортированы в САПР для создания моделей-реплик повреждённых областей. Этот процесс позволяет в дальнейшем создать и произвести сложные пористые структуры био-скаффолдинга с помощью аддитивного быстрого прототиптрования (RP), также известного, как 3D-печать, или, в более общем смысле, аддитивного производства. Существует несколько видов технологий аддитивного RP-производства -- которые, как правило, отражают способ формирования готового изделия. Все техники используют схожий процесс, описанный ниже, с различиями стадии печати (изготовления.) Обратите внимание, что подпроцесс конвертирования в машинные команды выполняется через сохранения САПР-файла в формат .STL (стереолитография.) Рисунок 1 показывает процесс, который используется в аддитивном производстве.
III. Типы технологий аддитивного производства
На данный момент существуют различные AM-технологии, которые используются для создания био-имплантов, такие, как Inkjet Printing (Polyjet), 3D-печать (3DP), Стереолитография (Stereolithograpy, STL), выборочное спекание слоёв (Selective Layer Melting, SLM) и био-печать, которая является отдельной категорией сама по себе. Они классифицируются разными способами, такими, как тип используемого источника энергии, процесс производства и т.д. Для данной статьи, мы будем классифицировать их на основе возможности печатать биологические материалы: непосредственно (i), или косвенно (ii).
- Непосредственно -- совместная печать поддерживающей структуры и биологических материалов (клеток, ДНК, белков), также известная, как Биопечать.
- Косвенно -- печать только поддерживающих структур.
Непосредственная био-печать привлекла большое внимание в научных кругах, так как существует потребность в точном позиционировании клеток и архитектуре тканей в 3D структурах с микроскопической точностью. Сейчас существуют три основных способа печати тканей непосредственно на имплантах: (i) Inkjet, (ii) Экструзия и (iii) Laser Assisted Based (LAB). Косвенные технологии печати не печатают биоматериалы. Такие методы используются, в основном, для изготовления скаффолдов, которые затем используются для выращивания клеток, систем доставки лекарств, а также потенциально применимы био-чипах и био-сенсорах. Тем не менее важно учесть, что каждая технология имеет свои ограничения и применения. Текоторые технологии (такие, как SLA, Inkjet-подобные системы) используют ультрафиолетовый или белый свет для отвердения материалов, в то время, как другие используют лазер для расплавления или размегчения материала для их склейки (SLS, SLM), и некоторые (3DP) используют связывающие материалы, такие, как клей, для склейки материала.
A. Fused Deposition Modelling (FDM)
Слой за слоем, геометрия поперечного сечения детали выкладывается с помощью экструдирования материала в виде лески (филамента) через сопло с контролируемой температурой нагрева. После того, как расходный материал выходит из сопла, он затвердевает и прикрепляется к слою ниже.[original-sources 8] Материалы, используемые в данной технологии -- это, в основном, термопластики, такие, как: ABS, Polycarbonate, биоразлогаемый PLA или PLGA[original-sources 9], а также материалы с низкой температурой плавления.[original-sources 10] Эта технология известна грубостью поверхности изготовленной детали, медленную скорость производства и значительными ограничениями на минимальный размер стенок, накладываемыми диаметром сопла. Также при печати требуется поддерживающий материал.[original-sources 8][original-sources 10] (рис. 2)
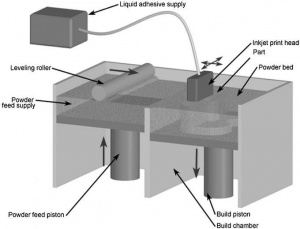
B. Tree-Dimensional Printing (3DP)
Слой за слоем, пудра из материала выкладывается тонким слоем и струйная печатающая головка с жидким связующим веществом склеивает частицы материала вместе[original-sources 10] (рис. 3.) Материалы для 3D-печати включают в себя полимеры, керамику, песок и металлическую пудру (например, из нержавеющей стали.) Технология известна быстрой скоростью печати, грубостью поверхности изготовленной детали, непрочными деталями и возможностью многоцветной печати. Поддерживающий материал не требуется, но требуется пост-обработка и укрепление детали.[original-sources 8] В данной технологии могут быть использованы биосовместимые и биоразлагаемые материалы, однако сложен процесс поиска правильного связывающего вещества. Из-за размера зерна расходного материала, наличия связывающего материала и методов пост-обработки, технология 3DP имеет ограничения в использовании био-молекул и в минимальном размере создаваемого объекта.[original-sources 11]
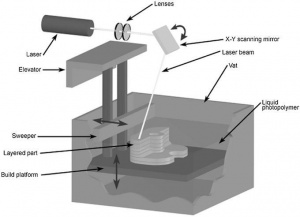
C. Stereolithography (STL или SLA)
Ультрафиолетовый лазер фокусируется на ёмкости с фоточувствительным полимером, очерчивая контуры одного слоя объекта за один проход. Эта технология известа высоким качеством поверхности напечатанного объекта и высокой детализацией, средней скоростью печати и широким спектром доступных материалов. Стереолитография требует создание поддержек, их последующее удаление и пост-обработку.[original-sources 8][original-sources 10]
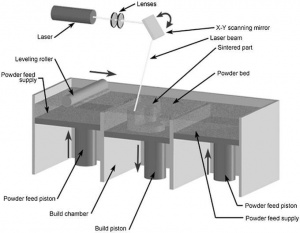
D. Selective Laser Sintering (SLS)
Технология SLS комбинирует выборочное отвердение исходного материала в SLA и склейку измельчённого в пудру материала из 3DP. В целом эта технология известна средним качеством поверхности из-за размеров частиц исходного материала,[original-sources 10] хорошей стабильностью и функциональностью готового изделия, быстротой печати и широким спектром материалов -- таких, как резино-подобные материалы (SOMOOS), био-совместимые и био-разлагаемые полимеры и металлические композиты, применимые в условиях высоких температур. Технология SLS не требует поддерживающий материал, и напечатанным деталям требуется лишь минимальная пост-обработка[original-sources 8] (рис. 5.)
IV. Био-импланты и их типы
Био-импланты обычно обладают требованиями, специфическими для каждого потребителя и производятся в небольших объёмах. Как следует из их названия, био-импланты предназначены для клинического применения в медицине, такого, как пористые импланты, протезы, инструментов доставки лекарств. Они называются имплантами, так как они обычно в том или ином виде имплантируются в тело человека на длительный период времени.
Существуют три вида био-имплантов, которые можно классифицировать следующим способом:
- Биологические импланты
- Биологизированные импланты
- Био-функциональные импланты
Различия между этими тремя категориями заключается в количестве клеточных компонентов, которые состовляют имплант.
A. Биологические импланты
Биологические импланты производятся из биологических материалов, таких, как клетки, белки и т.п., посредством био-печати. Обычно для изготовления био-импланта требуются два основных компонента; в первую очередь это -- био-принтер, содержащий материалы, такие, как живые клетки (например, стволовые клетки или тканевые сфероиды, биоразлогаемые скаффолды/матрицы, или гидрогели, которые используются для задания 3D-формы создаваемого органа.) Печать органов можно определить, как компьютерезированный процесс, в котором клетки или клеткосодержащие материалы размещаются в форме агрегатов, которые затем используются в качестве строительных блоков, собираемых в дальнейшем в готовый функциональный 3D-орган. Возможность создавать копии органов через точное позиционирование множества клеток в необходимых местах может позволить коммерчески производить органы, адаптированные для пациентов. Обычно это требует интеграции трёх областей:
- функциональность клеток, гарантирующая, что каждая клетка делает свою работу;
- производство органа или ткани через комбинирование клеток и 3D-скаффолда, с использованием техник био-производства
- оценка созданных био-структур, с акцентом на проблемах иммунологии, токсичности и возможности импланта сохранять его форму после имплантации.
Хотя на данный момент нет полноценных напечатанных органов, но с развитием технологий проведением исследований мы можем увидеть применение данной технологии раньше, чем думаем.
B. Биологизированные импланты
Биологизированные импланты изготавливаются из клеточных материалов и перманентных био-материалов. Различие между био-имплантами и биологизированными имплантами заключается в способности биоразложения 3D-структуры. Структуры в биологизированных имплантах являются перманентными и неразлагаемыми биологически. Перманентные биоструктуры в таких имплантах био-совместимы и являются предоставляют механическую основу для клеточной колонии. Большая часть биоматериалов, используемых в имплантах, биоинертны (материалы не реагируют с тканями тела; имплант покрывается тонким слоем слизистой мембраны.) Например, нержавеющая сталь, тантал, золото, нитинол и т.д. Этот раздел ставит акцент на ортопедических и дентальных имплантах, в основном создаваемых из металлов и использующих непрямой способ печати с применением титана и его сплавов. Большая часть дентальных имплантов и множество других ортопедических имплантов использую титан и его сплавы. Использование аддитивного производства в стоматологии имеют большой потенциал из-за потребности в этой области производить импланты со сложной геометрией, малым объёмом производства и потребностью персонализированной адаптации под пациента. Было проведено исследование прямого применения технологий SLS и SLM для печати стоматологических протезов из нержавеющей стали и сплавов Ti6Al4V CoCr. Также были изучены другие исследования применения технологии SLM в стоматологии. Есть большой потенциал в применении быстрого прототипирования и аддитивного производства в стоматологической области.
C. Био-функциональные импланты
Биофункциональньность подразумевает оптимальное использование поверхности импланта для практических целей. Это означает, что после имплантации, биоактивная поверхность подобного импланта взаимодействует с биологическим окружением тела. В этих случаях требуется разработка и правильное применение адаптированных свойств основных материалов импланта. Материалы биофунциональных имплантов обычно биологически активных. Под биоактмвными поднимаются материалы, которые интегрируются в организм без образования капсулы вокруг, и формирующие постоянную связь с окружающими тканями. К ним относят стеклокерамику, гидроксиапатит и стеклоиономерный цемент. Было показано, что спользование скаффолдов, изготовленных методом 3DP из гидроксиапатита или трикальцийфосфата (TCP), может улучшить пролиферацию и распространение клеток, по сравнению с существующими коммерческими продуктами -- такими, как замена кости BioOss®. Команда Эльке, используя 3DP, смогли распечатать имплант с гидроксипропилметилцеллюлозой (HPMC) и трикальцийфосфатом (TCP), локализованной органической биоактивной нагрузкой (рекомбинантный костный морфогенный белок 2 (rhBMP-2), гепарин (модельный полисахарид) и ванкомицин (антибиотический гликопептид) и локализованным контролем диффузии одновременно.[1]
D. Инжиниринг тканей и регенеративная медицина
Инженерия тканей -- это применение принципов и методов инжиниринга и естесственных наук для создания живой ткани для замены или восстановления сбоящего органа, повреждённой или отсутствующей части тела.[original-sources 12] Термин "инжиниринг тканей" был впервые представлен научному сообществу в 1993 году авторами Langer и Vacanti[original-sources 13] в контексте разработки биологических протезов, которые поддерживают, улучшают или восстанавливают функцию тканей. Продукты инжиниринга тканей (TEPs) обычно являются кобминацией трёх компонентов, например изолированных клеток, внеклеточного матрикса (всех клеток, окружённых сложной смесью неживого материала) и сигнальных молекул, таких, как факторы роста. Структура, обычно назваемая "скаффолдом" предоставляет новые возможности для внеклеточного матрикса, поддеживая трёхмерное пространство для формирования новых тканей с необходимыми функциями. Хорошо известно, что взаимодействие клеток и внеклеточного матрикса имеет большое значение для функционирования конечного изделия. Полимеры имеют прекрасные физические свойства, такие, как большая площадь поверхности, высокая пористость, взаимосвязь пор в случае с нановолокнисными матриксами с хорошо контролируемой скоростью разложения и биосовместимостью полимерной основы, что делает их идеальными кандидатами для разработки скаффолдов для инженерии тканей.[original-sources 14]
E. Нано-материалы и импланты
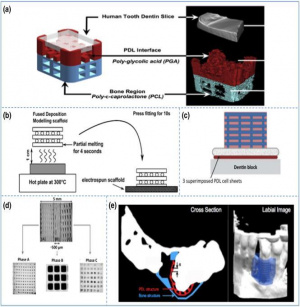
Физические и химические характеристики обычных макро-материалов полностью отличаются по сравнению с более мелкими наночастицами; в частности, квантовые эффекты становятся более явными для частиц материи размером 100нм или меньше.[original-sources 15] Одно из свойств нано-материалов, заключающийся в пропорционально большой площади поверхности по сравнению с объёмом, позволяет нанофазным материалам более легко вступать в реакцию с окружающими структурами. Некоторые исследователи показали, что нанокристаллический слой способствует росту и связке окружающей костной ткани.[original-sources 16][2] In vitro исследования также показали, что костнообразующие клетки (остеобласты) лучше прикрепляются и поставляют больше кальция на материалы с размером зерна в микрометрическом диапазоне.[original-sources 17] Надлежащее, координированное функционирование всех клеток необходимо для формирования и поддержания здоровой костной ткани и, таким образом, надёжной связи между имплантом и окружающей костью.[original-sources 18] Это крайне важно для имплантов, которые прикрепляются без использования костного цемента. Тонкий слой нанокристаллической структуры на искусственных имплантах, таких, как искусственные бёдра (которые обычно изготавливаются из титана или сплавов кобальта и хрома) может помочь уменьшить проблемы износа или разнашивания импланта. Нанокристаллическая структура более жёсткая, гладкая, является хорошим связующим, и, как результат, приводит к большему сопротивлению к износу искусственного сочленения, который обычно изготавливается из специального вида полиэтилена. Гидроксиапатит являтся натуральным компонентом кости, 70% которой состоит из гидроксиапатита, и 30% состоит из органических волокон (коллагена.) Покрытие гидроксиапатитом с размером зерна в нанометровом диапазоне вместо микрометрового делает имплант более биосовместимым и более похожим на естесственный гидроксиапатит кости, который также имеет нанокристаллическую структуру (с размером зерна менее 50нм.) Наночастицы гидроксиапатита также могут быть использованы для восстановления костной ткани повреждённой кости, что было впервые показано в Маастрихском университетском госпитале (Maastricht UMC+) в 2000-м году, при использовании искусственного бедра с нанокристаллическим слоем гидроксиапатита. Кроме гидроксиапатита, другие материалы, такие, как алмаз или керамика, могут быть использованы при создании импланта.[original-sources 17]
V. Ограничения AM-технологий в области медицины
Хотя без сомнения медицинские модели являются хорошими помощниками в решении сложных хирургических проблем, существуют множественные недостатки AM-технологий, связанных с их использованием в области создания медицинских моделей. Одна из причин этого отчасти заключается в том, что AM-оборудование было изначально разработано для решения более общих проблем производства, нежели для решения медицинских задач; поэтому разработка технологии была направлена на улучшения, связанные с решением проблем производственников, а не докторов или хирургов. Тем не менее, недавние и будущие улучшения AM-технологий могут открыть двери для более широкого их использования в медицинской индустрии. Ключевыми проблемами, решение которых поможет решить вышеописанные недостатки, являются:
- Скорость
- Стоимость
- Точность
- Доступные материалы
- Лёгкость в использовании
Анализируя данные проблемы, мы можем определить, какие технологии могут быть наиболее подходящими для медицинского использования, также как и узнать, как эти технологии будут развиваться в будущем для лучшего соответствия решаемым задачам.
VI. Дальнейшие разработки в области медицинского применения AM-технологий
Сложно сказать, в какой мере AM-технологии подходят для медицинского применения. Причиной является большое количество способов, как эти машины могут быть применены в данной области. Можно предположить, что разные технологии могут найти своё применение в разных областях медицины, в связи с их специфичными преимуществами, ими предоставляемыми. Тем не менее наиболее распространённые коммерческие машины определённо хорошо подходят для промежуточное звено между хирургами, техническим персоналом и пациентами. Изготовленные модели также могут быть полезны в роли диагностических средств и могут помочь в планировании, разработки хирургических процедур, разработке хирургических инструментов и даже для разработки собственно протезов. Непосредственное изготовление имплантов и протезов, тем не менее, ограничено AM-технологиями, использующими печать металлом, которые позволяют изготовить детали с использованием материалов, одобренных FDA. Также можно использовать ограниченное количество технологий, которые могут изготовить несущие полимерные скаффолды. Для того, чтобы больше данных технологий было принято к использованию в медицинской области, в индустрии должны быть учтены ряд факторов:
- Разрешения к использованию
- Страхование
- Обучение инженеров
- Доступ к технологии
VII. Заключение
Обобщая всё вышесказанное, аддитивное производство позволит серийное производство или индивидуальное изготовление улучшенных медицинских имплантов. Аддитивное производство позволяет адаптировать импланты для конкретного человека и данная статья показала, что оно уже используется для создания более качественных титановых костных имплантов, протезов конечностей и ортодонтических аппаратов. По мере того, как больше меж-дисциплинарных исследователей привлекаются в работу в данной области, и идёт прогресс в области био-материалов, скорее всего инструменты и техники аддитивного производства будут и дальше улучшаться в последующие года.
Сноски
- ↑ E. Vorndran, U. Klammert, A. Ewald, J. E. Barralet, and U. Gbureck, "Simultaneous Immobilization of Bioactives During 3D Powder Printing of Bioceramic Drug-Release Matrices," Advanced Functional Materials, vol. 20, pp
- ↑ Добавил 18-ю ссылку, хотя в оригинале на неё авторы не ссылаются. Судя по контексту, это -- самое подходящее место. -- avp
Источники из оригинальной статьи
- ↑ Ivanovski, S., C. Vaquette, S. Gronthos, D. W. Hutmacher, and P. M.Bartold. Multiphasic scaffolds for periodontal tissue engineering. J.Dent. Res. 93:1212–1221, 2014.
- ↑ Obregon, F., C. Vaquette, S. Ivanovski, D. W. Hutmacher, and L. E. Bertassoni. Three-dimensional bioprinting for regenerative dentistry and craniofacial tissue engineering. J. Dent. Res. 94:143S–152S, 2015.
- ↑ Groll, J., T. Boland, T. Blunk, J. A. Burdick, D. W. Cho, P. D. Dalton, B. Derby, G. Forgacs, Q. Li, V. A. Mironov, and L. Moroni. Biofabrication: reappraising the definition of an evolving field. Biofabrication 8:013001, 2016.
- ↑ Park, C. H., H. F. Rios, A. D. Taut, M. Padial-Molina, C. L. Flanagan, S. P. Pilipchuk, S. J. Hollister, and W. V. Giannobile. Image-based, fiber guiding scaffolds: a platform for regenerating tissue interfaces. Tissue Eng. Part C 20:533–542, 2014.
- ↑ Bernd, B., Marc A.: Computational aspects of fabrication. IEEE Xplore, Published Comp. Graph. Appl IEEE 33(6), Nov–Dec, 2013. http://ieeexplore.ieee.org/stamp/stamp.jsp?arnumber=6682932. Accessed 6 Aug 2014
- ↑ CT Scan versus MRI: diffen.com. http://www.diffen.com/difference/CT_Scan_vs_MRI. Accessed 10 Aug 2014
- ↑ Grenda, E.: Medical applications of rapid prototyping. January 2007. http://www.additive3d. com/med_lks.htm. Accessed 12 Aug 2014
- ↑ 8,0 8,1 8,2 8,3 8,4 Additive Fabrication: 2009. http://www.custompartnet.com/wu/additive-fabrication. Accessed 12 Aug 2014
- ↑ Yen, H., Tseng, C., Hsu S., Tsai, C.: Evaluation of chondrocyte growth in the highly porous scaffolds made by fused deposition manufacturing (FDM) filled type П collagen. Biomed. Microdevices 11, 615–624, December 2008. http://link.springer.com.libraryproxy.griffith.edu.au/article/10.1007%2Fs10544-008-9271-7. Accessed 4 Aug 2014
- ↑ 10,0 10,1 10,2 10,3 10,4 Dao, D.: Precision Engineering & Prototyping. Lecture Notes. Rapid Prototyping & Reverse Engineering, ENG3313, School of Engineering, Griffith University, Gold Coast, (2014)
- ↑ Bose, S., Vehabzadeh S., Bandyopadhyay, A.: Bone tissue engineering using 3D printing. Mater. Today 16(12), 496–504, December 2013. http://ac.els-cdn.com/S136970211300401X/1-s2.0-S136970211300401X-main.pdf?_tid=4828c698-625b-11e4-82b2-00000aacb361&acdnat=1414910672_1265a1484f587bc95051d74847f93832. Accessed 6 Aug 2014
- ↑ Skalak, R. and C.F. Fox, Tissue engineering: proceedings of a workshop, held at Granlibakken, Lake Tahoe, California, February 26-29, 1988. Vol. 107. 1988: Alan R. Liss.
- ↑ Langer, R. and J. Vacanti, Tissue engineering. Science 260: 920-926.TISSUE ENGINEERING: THE UNION OF BIOLOGY AND ENGINEERING, 1993. 98.
- ↑ Nair, L.S., S. Bhattacharyya, and C.T. Laurencin, Development of novel tissue engineering scaffolds via electrospinning. Expert opinion on biological therapy, 2004. 4(5): p. 659-668.
- ↑ Sichert, J.A., et al., Quantum size effect in organometal halide perovskite nanoplatelets. Nano letters, 2015. 15(10): p. 6521-6527.
- ↑ Murphy, C.M, Haugh, M.G. O’Brien, F.J.: The effect of mean pore size on cell attachment, proliferation and migration in collagen glycosaminoglycan scaffolds for tissue engineering. Dublin, Ireland. Department of Anatomy, Royal College of Surgeons, Biomaterials. ch.31(3), pp. 461–466 (2010)
- ↑ 17,0 17,1 Shrivastava, S. and D. Dash, Applying nanotechnology to human health: revolution in biomedical sciences. Journal of Nanotechnology, 2009. 2009.
- ↑ Park, G.E. and T.J. Webster, A review of nanotechnology for the development of better orthopedic implants. Journal of Biomedical Nanotechnology, 2005. 1(1): p. 18-29.